炎症性肠病(IBD)被称为“不死的癌症”,会严重影响患者的生活质量,包括导致骨质丢失,大幅增加骨折风险。北京时间今天凌晨,上海长海医院骨科、消化内科与上海大学转化医学研究院合作的一项研究成果,在国际顶级科技期刊《细胞》子刊《细胞报告医学》在线发表,揭示了炎症性肠病引起骨丢失的新机制,并提出了新治疗策略,将为这类疾病的患者带来福音。

在《细胞报告医学》发表的上海科研论文
上海大学转化医学研究院院长、中华医学会骨科学分会青年骨质疏松学组组长苏佳灿介绍,炎症性肠病是以慢性炎症为特征的肠道疾病,主要分为溃疡性结肠炎和克罗恩病,前者主要累及结肠,后者可累及全肠道。日本前首相安倍晋三生前就患有溃疡性结肠炎,2020年因疾病复发,不得不辞去首相职务。
如今,随着生活节奏的加快,炎症性肠病的发病率和患病率在全球呈显著上升态势。过去10年,这种疾病在我国呈现出年轻化、漏误诊率高的特点。预计到 2025年,国内炎症性肠病患者将达到约150万人。
除了严重腹泻、肠穿孔等消化道症状,炎症性肠病还会引起严重的骨流失。据统计,炎症性肠病患者骨质减少、骨质疏松症的发生率分别达到67%和57.6%,相对骨折风险是正常人的1.3—1.4倍。目前,治疗指南要求摄入钙剂和维生素D以维持骨密度水平,但是这种疾病导致骨丢失的机制仍不明确。
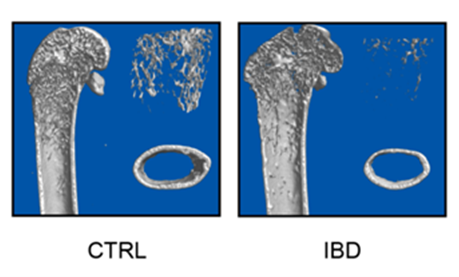
IBD模型显示骨量显著减少
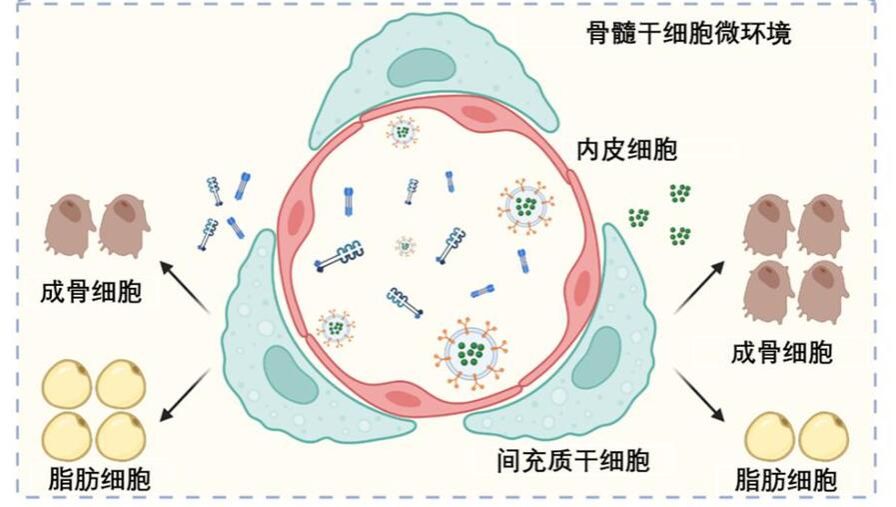
为此,苏佳灿教授带领团队,利用IBD模型对机制问题做了深入研究。他们发现,患者的长期慢性炎症状态会严重抑制骨髓内间充质干细胞的增殖和分化,导致生成骨头的成骨细胞越来越少,功能越来越差,而大量干细胞分化成无用的脂肪细胞。这是炎症性肠病导致骨丢失、骨折难愈合的重要原因。
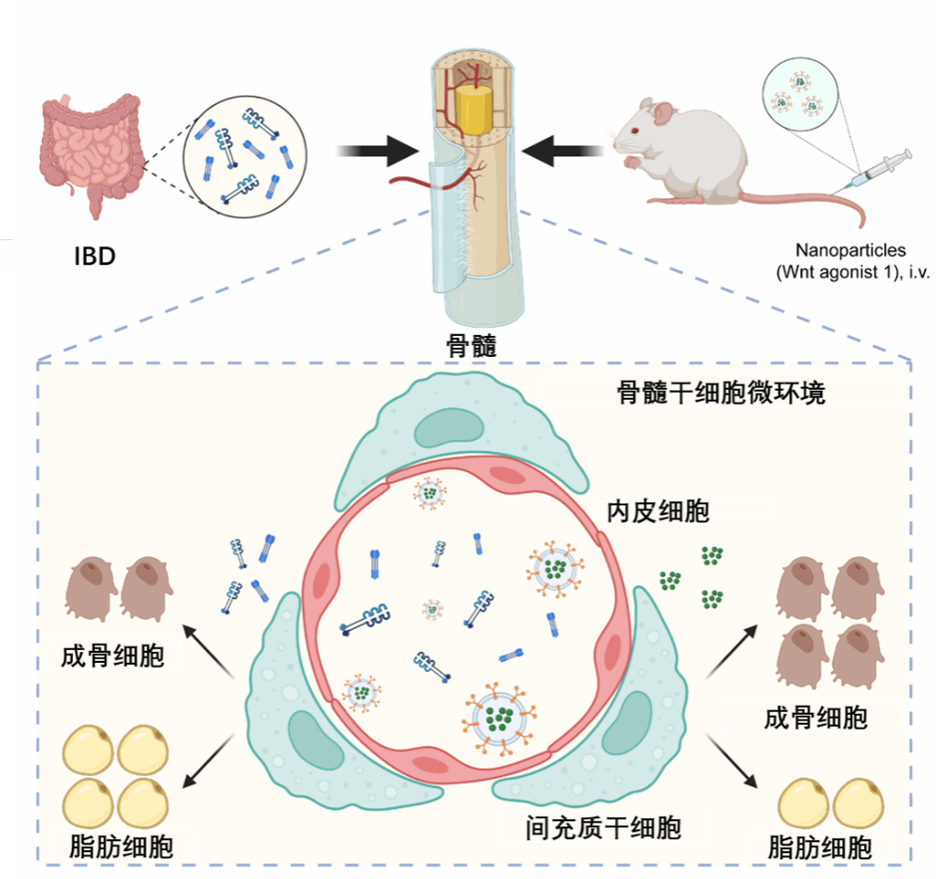
研究示意图
揭示这一机制后,临床上该如何改善骨髓内干细胞的状态,同时避免全身给药产生的副作用呢?研究团队想到了外泌体。它是细胞分泌的盘状囊泡,具有生物相容性好、改造方便、来源广泛的优点,可作为一种生物材料注射到体内。
在小鼠实验中,研究团队借鉴了前列腺癌骨转移的方式,在体外利用工具细胞获得了大量外泌体,再用Glg1分子对这些外泌体的表面进行修饰,使其具备了靶向骨分布的能力。随后,他们给骨靶向外泌体装载上治疗药物,研制出针对骨骼内干细胞的“精确制导武器”。
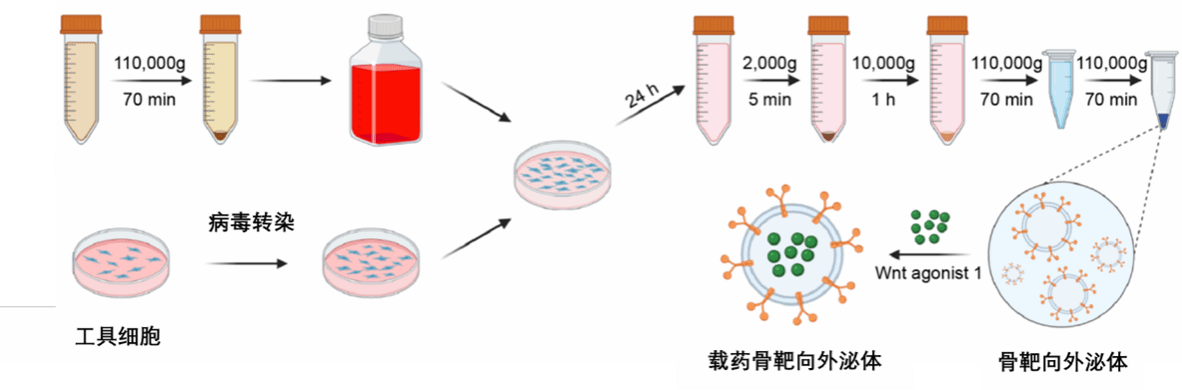
骨靶向外泌体生产过程
将“精确制导武器”注射入IBD模型小鼠的尾静脉后,实验结果显示,外泌体治疗提高骨密度和骨形成率近100%,能显著促进IBD模型小鼠的骨折愈合。
“我们将把这种治疗技术用于临床研究,争取在未来几年内实现临床转化。”苏佳灿说。令人期待的是,这种技术的应用不会局限于IBD骨丢失,一些现有治疗手段捉襟见肘的骨骼疾病,如类风湿性关节炎、强直性脊柱炎等,也有望通过骨靶向性外泌体实现高效的精准治疗。

