
2023年2月15日,上海大学转化医学研究院苏佳灿教授研究团队在中科院1区杂志Composites Part B(IF: 11.322)上发表了题为“Bone-targeted bioengineered bacterial extracellular vesicles delivering siRNA to ameliorate osteoporosis”的研究性文章(2023 April 15; 255:110610)。上海大学苏佳灿教授、井莹莹教授与西安交通大学周凤金教授为文章的共同通讯作者,课题组成员刘晗博士后、张浩博士后、王思成博士为文章的并列第一作者。
骨质疏松症(Osteoporosis,OP)是最常见的骨退行性疾病,其特征是骨量减少和骨微结构破坏。OP的常规药物治疗有很多副作用,包括生物利用度问题和毒性等问题,亟待需要新的治疗方法。基于RNAi的骨合成代谢基因疗法已被视为OP的潜在替代疗法,但由于缺乏特定的细胞靶向递送系统、半衰期短和穿透细胞膜的能力差,它受到了严重限制。细菌外囊泡(Bacterial extracellular vesicles,BEV)由于其独特的纳米尺寸结构、稳定的负载能力、良好的生物相容性、易于修饰和工业化而成为一种有前途的药物递送载体。因此,定制BEVs有望成为当前治疗OP的潜在方法。
基于课题组前期提出的骨靶向生物材料与“三位一体”骨修复理念,苏佳灿教授团队利用合成生物学手段改造益生菌Escherichia coli Nisle 1917(ECN),在BEVs膜表面展示骨靶向元件CXCR4,膜内部装载骨治疗元件SOST siRNA,定制同时具备骨靶向能力和骨治疗能力的工程化BEVs-hCXCR4-SOST siRNAs(BEVs-CSs)(图1)。定制的BEVs-CSs具有良好的骨靶向能力且无明显的体内毒性。BEVs-CSs可被骨髓间充质干细胞(BMSCs)内化,无明显的细胞毒性,且具有良好的促成骨分化能力。最终,BEVs-CS有效改善了OVX小鼠的骨质疏松症。总之,这种同时具备骨靶向与骨治疗能力的BEVs为OP治疗提供了一种创新、安全、高效和有前景的治疗方案。
原文链接:
Bone-targeted bioengineered bacterial extracellular vesicles delivering siRNA to ameliorate osteoporosis - ScienceDirect
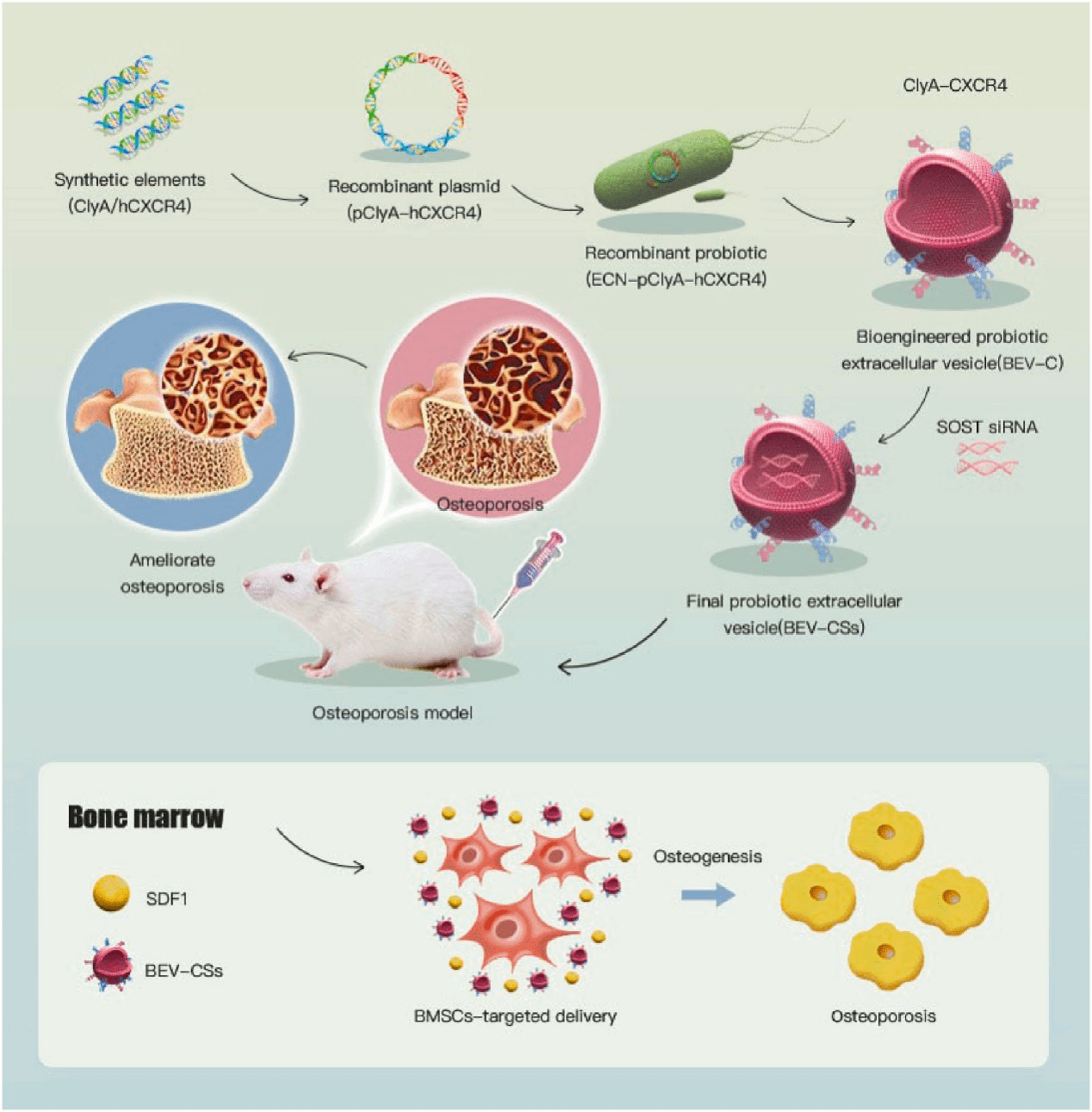
骨靶向工程化BEVs的构建和抗骨质疏松机制
苏佳灿教授团队利用细胞外囊泡在治疗骨与关节退行性疾病领域中具有丰富的研究经验,已经发表了多篇细胞外囊泡相关的高水平论文(Nano Lett, 2019, 19, 3040-3048, IF: 12.262;Nano Today, 2022, 44, 101487, IF: 18.962;Bioact Mater, 2021, 6 2905-2913, IF: 16.744等)。但动物来源的细胞外囊泡存在一些局限性,例如改造难,产量低,产业化难等。针对这一痛点,苏佳灿教授团队最近着力于研究细菌外囊泡领域。细菌具有快速增殖的能力、完善的基因编辑工具和成熟的高密度培养技术等优势,基于BEVs的治疗是一个有前途的战略,可以克服与哺乳动物细胞外囊泡和其他合成纳米材料有关的大规模生产问题。合成生物学的进步也使得定制化多功能的BEVs成为可能。
目前,苏佳灿教授团队已经确定了BEVs的高效分离方法,并总结和展望了BEVs作为药物递送载体在疾病中的优势与挑战(Han Liu et al. Bioact Mater, 2022, 14, 169-181,IF: 16.874);系统性比较了BEVs与外泌体的机制、提取、工程化改造策略及应用的差异,重点介绍了两者在组织工程中靶向治疗的应用(Han Liu et al. Extracell Vesicles Circ Nucleic Acids, 2022, 3, 63-86, 封面文章);从肠骨轴出发,创新性地提出了基于合成生物学的BEVs定制化方法,为骨退行性疾病的治疗提供了全新的见解(Han Liu et al. Chem Eng J, 2022,450, 4, 138309,IF: 16.744);系统介绍了BEVs的生物发生机制、分离纯化方法与内化机制,全面总结了BEVs在肿瘤治疗中的宿主来源与应用策略,展望了BEVs在BSTTs的治疗潜力及其优势与挑战(Han Liu et al. Theranostics. 2022. 12 (15): 6576-6594. IF:11.600)。这些积累为工程化细菌外囊泡用于骨质疏松症的治疗奠定了夯实的基础。

