上海大学转化医学研究院/上海交通大学医学院附属新华医院苏佳灿教授团队,2025年12月22日在 Bioactive Materials 发表题为“Artificial Intelligence Virtual Organoids (AIVOs)”综述性论文,率先提出并系统阐释虚拟类器官这一新概念,为类器官研究从实验驱动向数据—模型—预测驱动范式转变提供了清晰框架与方法学路径,也进一步巩固我国在类器官智能化与转化医学前沿方向学术影响力。上海大学转化医学研究院白龙副研究员为论文第一作者,上海大学转化医学研究院/上海交通大学医学院附属新华医院苏佳灿教授为论文通讯作者。

一、从“湿实验”到“硅基计算”:何为 AIVOs?
传统类器官虽然精妙,但本质上仍受限于物理法则和生物耗材。文章首先界定了AIVOs(硅基类器官)的概念边界:这是在计算空间中实例化的类器官尺度的数字孪生体。
在这个虚拟世界中,“虚拟细胞”是最小的可执行单元。它不仅仅是数据的堆砌,而是融合了多模态纵向测量数据,并利用受生物物理先验约束的“虚拟仪器”来模拟各种实验分析和扰动。这不仅是一个静态模型,更是一个具备动态演化能力的智能系统。
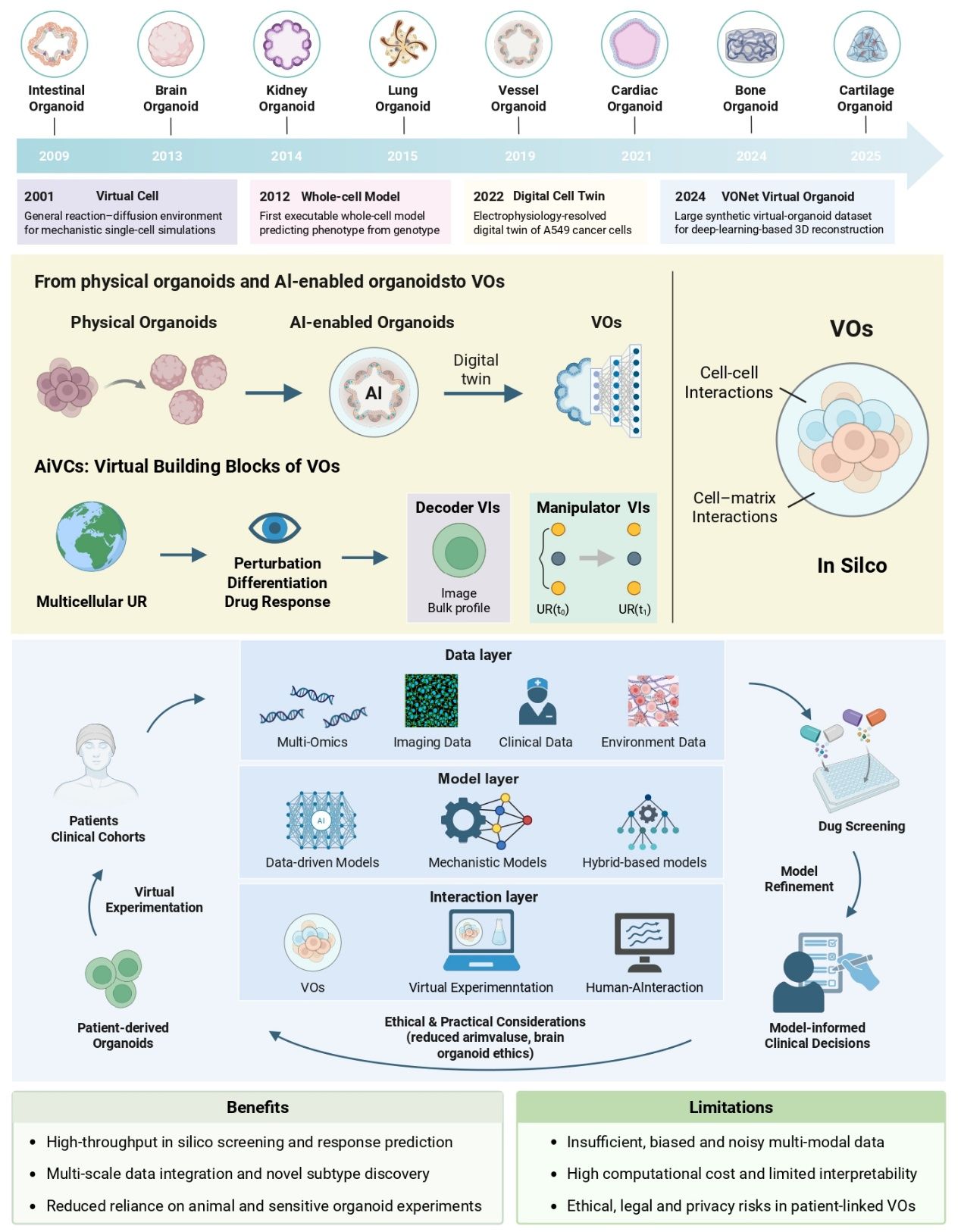
图1. 虚拟类器官:演变、构建与生物医学应用
本图宏观展示了类器官技术从“物理实体”向“数字孪生”的演进路径。
左侧(现状):物理类器官面临批次效应(Batch effects)、终点检测破坏性(End-point assays)以及难以规模化(Barriers to scale)的三重挑战。
中间(桥梁):通过多模态感知与AI算法,搭建起连接现实与虚拟的桥梁。
右侧(愿景):AIVOs在计算机中实现了全时空连续监测。虚拟类器官不仅能重现细胞的生长分裂,还能进行“虚拟扰动”(如虚拟给药),且所有操作均为非侵入性、可逆且无限重复的。这标志着实验范式从单纯的In Vitro向In Silico的深度融合。
二、构建逻辑:数据-模型-交互的三位一体
构建一个逼真的虚拟类器官,绝非简单的图像渲染。作者提出了一套严密的架构,即“数据-模型-交互”闭环:
1. 数据融合(Data):整合高内涵显微成像、单细胞测序(scRNA-seq)、生化检测等多模态数据,形成统一的状态表征。
2. 混合机制模块(Model):这是AIVOs的“引擎”。它并未完全依赖黑盒AI,而是结合了基于主体(Agent-based)的模型来模拟单个细胞行为,有限元(Finite-element)模型来计算力学环境,以及连续介质模型来模拟物质运输。
3. 交互层(Interaction):提供虚拟实验的操作接口,允许研究人员像在真实实验室一样进行操作。
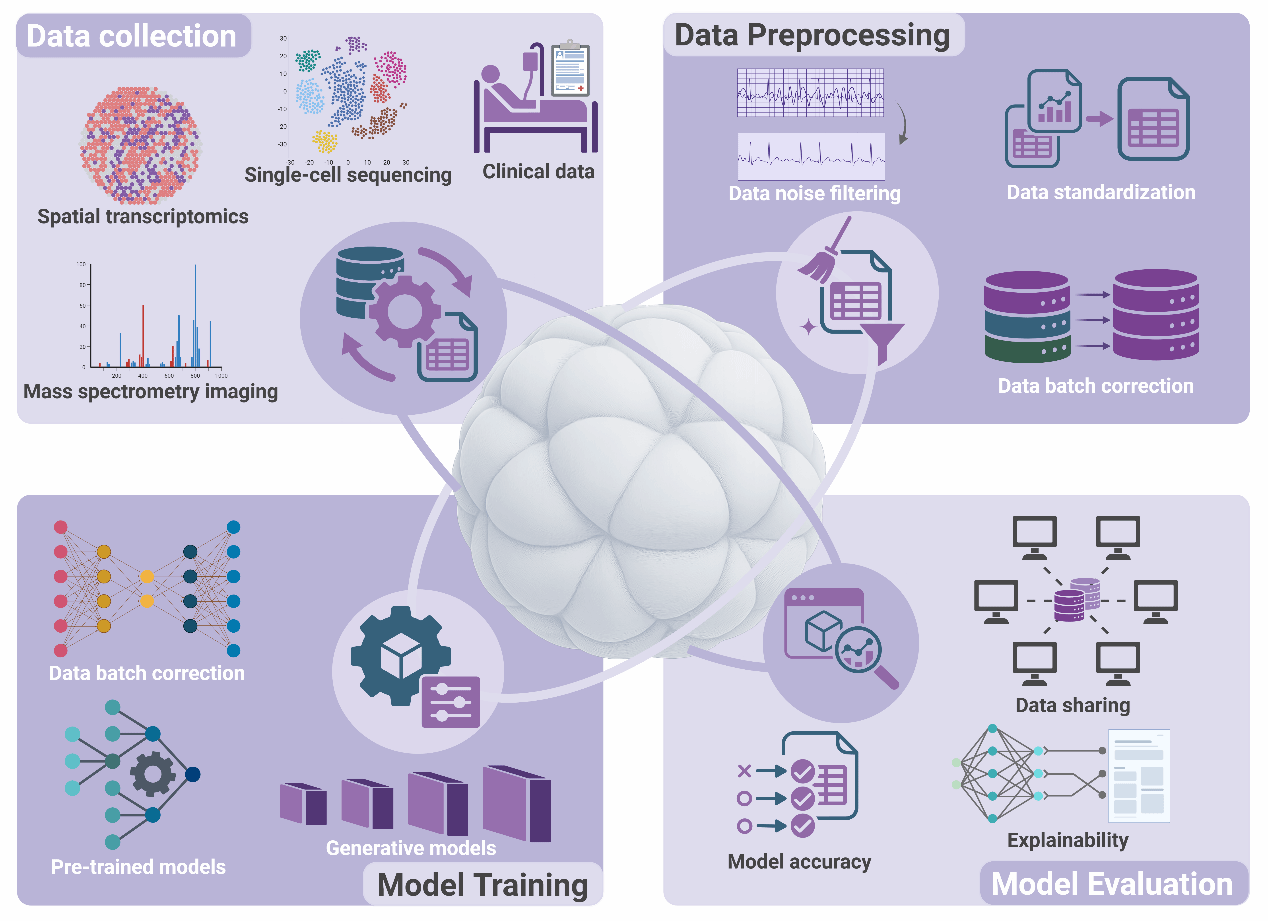
图2. 虚拟类器官的构建架构
本图详细解析了AIVOs系统的核心工程架构。
数据层(Data Acquisition):利用微流控芯片和生物传感器获取高频、纵向的时间序列数据,解决传统方法数据稀疏的问题。
建模层(Modeling):采用混合建模策略(Hybrid Modeling)。一方面利用深度学习(Deep Learning)从大数据中提取特征,另一方面引入生物物理方程(Biophysical Priors)作为约束,确保模型的预测符合生物学基本定律(如质量守恒、扩散动力学)。
交互层(Interaction):构建可视化的数字孪生界面,研究人员可在此界面上调整参数(如氧气浓度、药物剂量),实时观察类器官的形态和功能响应。
三、核心驱动:虚拟干细胞的“发育算法”
类器官的生长本质上是干细胞的分化与自组装过程。在AIVOs中,这一过程被转化为一套精密的“发育算法”。
虚拟干细胞(Virtual Stem Cells)作为系统的核心骨架,内置了分化决策树。它们感知周围环境的信号(如生长因子梯度、邻居细胞的机械力),自主决定是自我更新、分化还是凋亡。这种自下而上(Bottom-up)的涌现行为,成功复刻了真实组织的复杂空间结构。
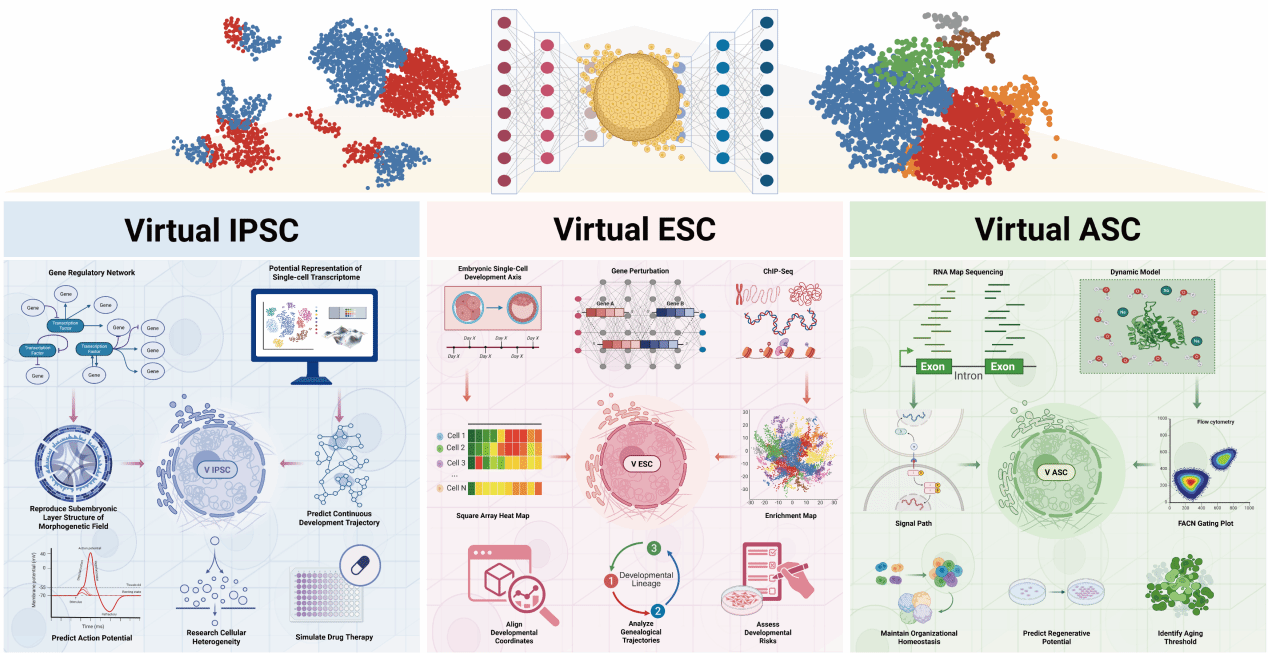
图3:虚拟干细胞作为虚拟类器官的发育骨架
本图揭示了AIVOs的时空演化机制。
图中展示了虚拟干细胞(Virtual Stem Cells)如何依据预设的规则库(Rule-based definition)和随机概率模型(Stochastic models)进行分裂和分化。
通过模拟细胞-细胞粘附力和细胞-基质相互作用,虚拟细胞在三维空间中自动组装成囊泡状或分支状结构,重现了类器官发育过程中的对称性破缺(Symmetry breaking)和形态发生(Morphogenesis)。这是AIVOs区别于静态3D模型的关键:它拥有“生长”的能力。
四、功能仿真:从基因表达至组织力学
仅仅长得像是不够的,AIVOs必须具备功能。研究团队引入了虚拟功能细胞的概念,使得虚拟类器官能够输出多维度的功能信号。
这包括但不限于:模拟神经类器官的电生理活动、心脏类器官的搏动频率,以及肿瘤类器官的代谢产物分泌。AI模型将微观的基因表达谱映射为宏观的功能表型,实现了跨尺度的功能预测。
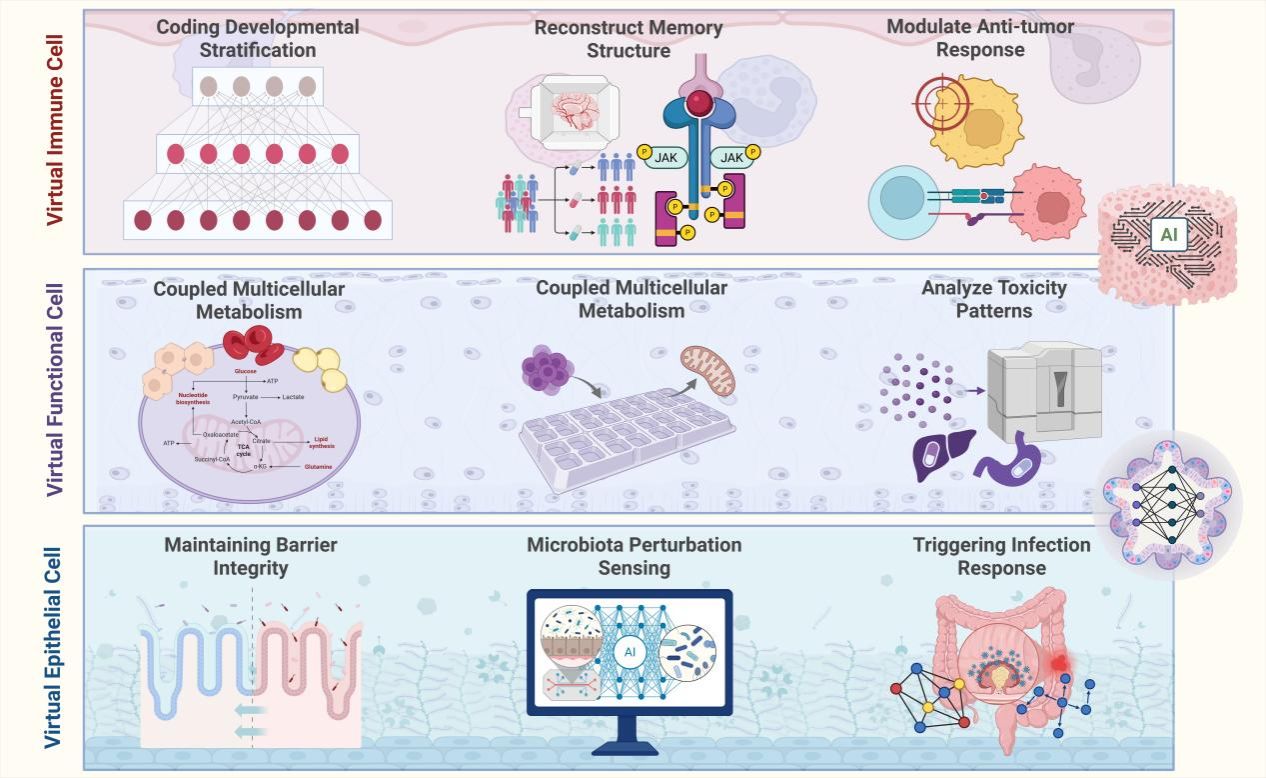
图4:虚拟功能细胞驱动的虚拟类器官多维功能输出
本图阐述了AIVOs的功能映射逻辑。
输入端:基于单细胞测序数据定义的各种细胞亚群(如神经元、胶质细胞、心肌细胞)。
处理端:通过多物理场耦合(Multiphysics Coupling),模拟细胞间的电信号传递、化学物质扩散和机械力传导。
输出端:生成虚拟的“功能读数”,如钙成像信号(Calcium signaling)、收缩力曲线(Contractility)以及代谢通量(Metabolic flux)。这使得研究人员可以在没有物理传感器的情况下,通过计算推演评估类器官的生理状态。
五、疾病模型:肿瘤数字孪生与微环境
在肿瘤研究领域,AIVOs展现了惊人的潜力。文章重点讨论了虚拟肿瘤细胞(Virtual Tumor Cells)在构建肿瘤数字孪生中的作用。
不同于均质化的细胞系,AIVOs可以模拟肿瘤内部的高度异质性,以及肿瘤细胞与微环境(免疫细胞、成纤维细胞、血管)之间的博弈。通过调整虚拟参数,可以模拟缺氧、酸化等恶劣环境对肿瘤生长的影响,甚至预测肿瘤的耐药性进化路线。

图5:虚拟肿瘤细胞在虚拟类器官与肿瘤数字孪生中的跨尺度作用
本图展示了肿瘤AIVOs的跨尺度复杂性。
微观尺度:模拟基因突变导致的细胞周期失调和代谢重编程。
介观尺度:展示肿瘤球体内部的营养梯度(Nutrient gradient)和缺氧核心(Hypoxic core)的形成过程。
互作网络:描绘了虚拟肿瘤细胞如何通过分泌因子“驯化”虚拟成纤维细胞,重塑细胞外基质,从而促进侵袭和转移。这种全景式的模拟为理解肿瘤微环境(TME)的动态重塑提供了全新的视角。
六、临床愿景:闭环验证与决策支持
AIVOs的终极使命是回归临床。文章描绘了一个宏大的应用蓝图:从高通量药物筛选到个性化治疗方案的制定。
在AIVOs的辅助下,医生可以在患者实体类器官培养的同时,先在“硅基替身”上进行成千上万种药物组合的虚拟筛选(In Silico Screening),筛选出最可能的几种方案后再回到湿实验中验证。这不仅大幅缩短了检测周期,还为精准医疗提供了更安全、更经济的决策依据。
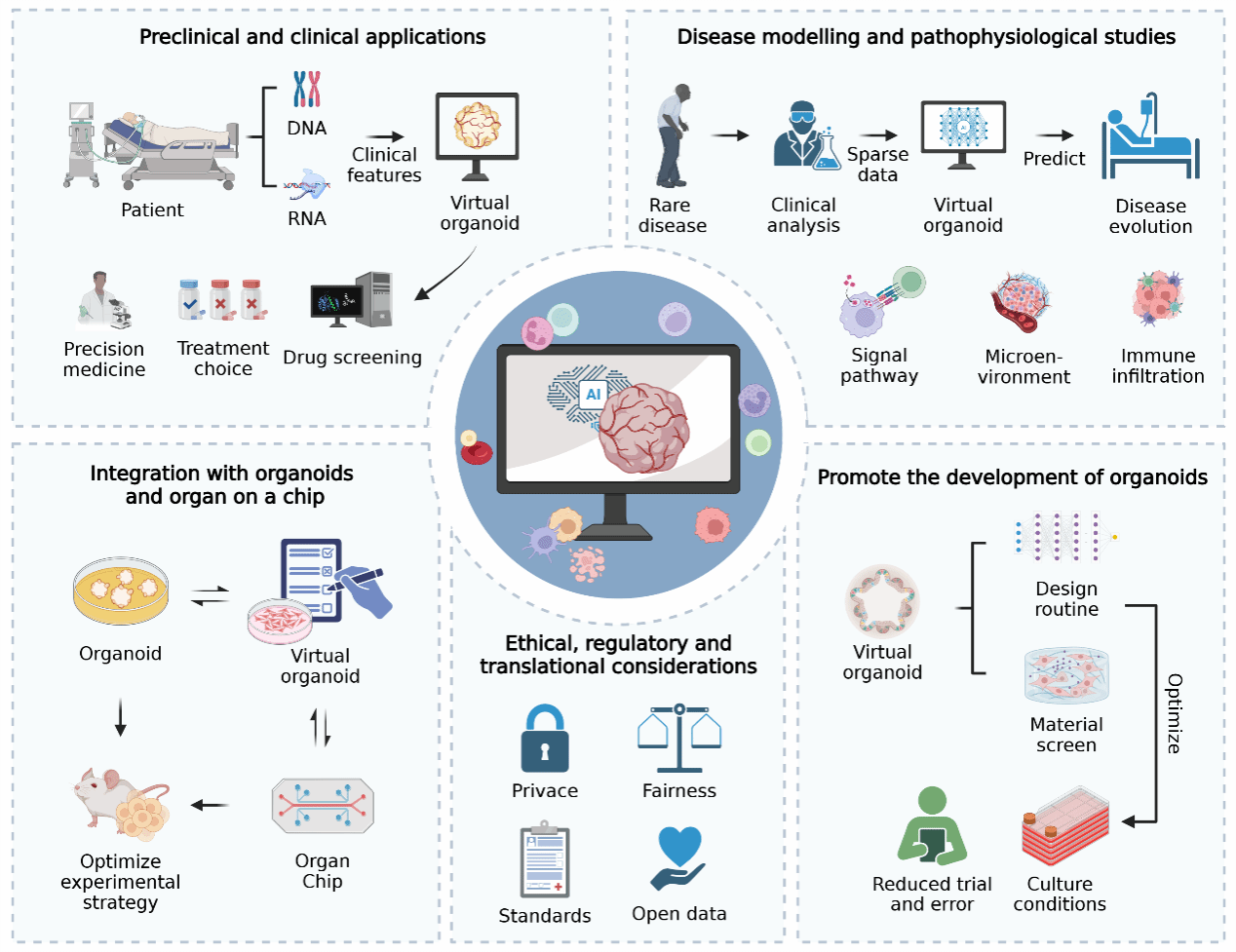
图6:虚拟类器官的全场景应用
本图总结了AIVOs在生物医学领域的四大核心应用场景。
1. 药物筛选(Drug Screening):利用虚拟高通量筛选(vHTS)快速排除无效化合物,优化先导化合物结构。
2. 剂量优化(Dosing Design):模拟不同给药频率和剂量下的药代动力学(PK/PD),寻找最佳治疗窗口。
3. 疾病分型(Disease Subtyping):基于虚拟表型特征,对患者进行更精细的分子分型。
4. 临床决策支持(CDSS):整合患者临床数据与AIVO预测结果,形成闭环的“Bedside-Bench-Bit-Bedside”精准医疗流程。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2452199X2500622X

