近期,上海大学转化医学研究院苏佳灿教授团队在科爱出版创办的期刊 Bioactive Materials 上联合发表研究论文:靶向人骨骼肌ssDNA核酸适配体的选择与鉴定,并被选为当期封面文章。该文首次通过SELEX方法筛选和鉴定可靶向人骨骼肌细胞的ssDNA适配体,该核酸适配体进一步通过纳米脂质体修饰后仍然成功靶向至骨骼肌细胞,这种新型脂质体修饰的ssDNA适配体体系可用于人类骨骼肌疾病的靶向治疗。
01 研究内容简介
核酸适配体是短的(15–100 nt)人工单链寡(脱氧)核苷酸(ssDNA或RNA),具有独特三维构象,可与靶分子形成稳定复合物。一般可通过指数富集配体系统进化(SELEX)的体外分子选择方法筛选核酸适配体。它们是一种能够识别和有效结合靶标的寡核苷酸探针,为靶向药物输送到骨骼肌提供了一种有前景的方法。核酸适配体具有靶标范围广泛(从细胞到金属离子)、合成和修饰简单、毒性和免疫原性低、体积小(直径约1-2nm)、在各种环境条件下稳定性好等优点。此外,在体外合成适配体可减少细菌或病毒的污染。具有功能的核酸适配体与关键功能分子结合,调节细胞信号通路,抑制细胞生长,诱导蛋白质降解。不具备功能的核酸适配体已被应用于各种生物医学应用,包括生物成像、体内外分子诊断和靶向药物传递。
在本研究中,作者使用Cell-SELEX筛选和鉴定了一个ssDNA核酸适配体,可以在体外和体内靶向人类骨骼肌细胞。同时作者将该适配体与纳米脂质体连接,构建适配体靶向脂质体Lipo-PEG-apt,并评估了其在体内和体外的靶向能力。该策略可用于肌肉疾病中药物定向转运到人体骨骼肌。
作者首先在体外筛选与人骨骼肌细胞相互作用的ssDNA核酸适配体。先合成一个ssDNA文库(Lib),中间有一个42 nt长的随机区域,左右两侧有两个固定的已知引物结合位点。在每一轮选择(聚合酶链式反应(PCR)扩增)中合成5 ' -修饰的引物。对于每一轮选择,随机ssDNA序列库针对目标细胞系(即人类骨骼肌细胞(HSKMCs)进行选择(阳性选择)。
通过Cell-SELEX评估适体富集。选择HSKMC为阳性细胞系,EA.hy926细胞为阴性细胞系,将FITC标记初始适配体Lib(第0轮)和第8、11、13轮筛选后扩增的FITC标记产物分别与HSKMCs和EA. hy926细胞结合,并采用流式细胞术检测其细胞结合能力。结果表明随着筛选轮数的增加,适配体特异性显著增强。到第11轮和第13轮,特异性保持稳定,扩增产物可用于DNA测序。
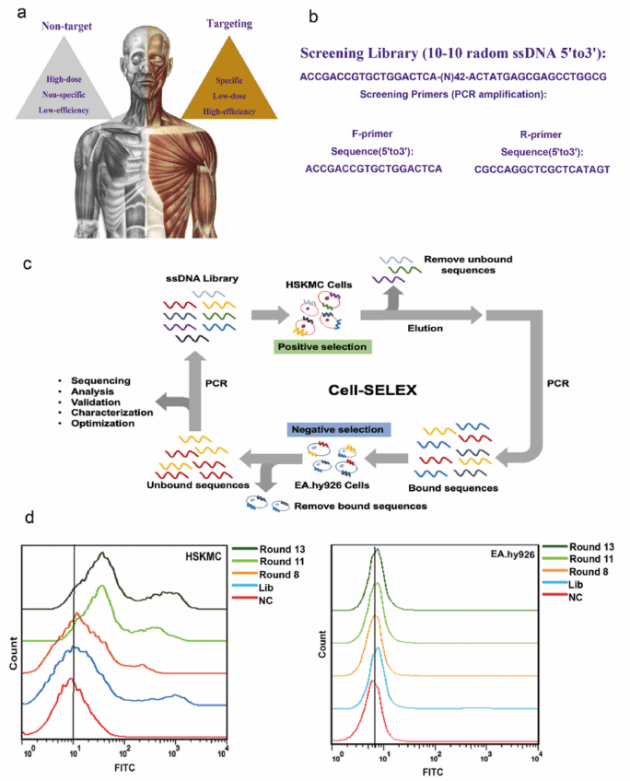
图1:适配体选择策略与选择。a.与非目标交付相比,目标交付优势示意图。b.合成初始单链DNA文库,中间设计一个42 nt长的随机区域,左右两侧有两个固定的已知引物结合位点。c.cell-SELEX工作流程示意图。d.在0轮、8轮、11轮、13轮筛选后,用扩增的FITC标记产物对HSKMC和EA. Hy926进行流式细胞实验。
作者对人骨骼肌细胞特异性ssDNA适配体进行鉴定。对第11轮和第13轮扩增产物进行高通量测序,用mega软件对第13轮测序排名前6位(HSM01、HSM02、HSM03、HSM04、HSM05、HSM06)的适配体进行比对,保守域从一个移到另一个,与初始筛选Lib进行结合特异性检测,结果显示,6个合成的适配体具有良好的结合特异性,其结合偏移范围无明显差异。最后选择测序报告中读取数最高的两个(HSM01和HSM02)作后续实验。结合动态曲线显示,这些适配体在10%血清培养液中的半衰期约为8小时。HSM01和HSM02 ssDNA适配体在4 ~ 8 h内稳定。
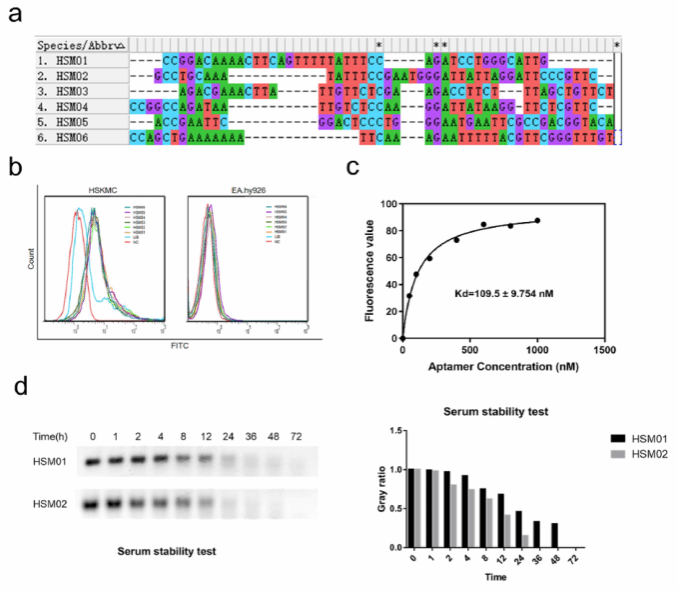
图2:DNA适配体表征。a. HSM01-06 Top 6测序结果比对。b.合成的HSM01-06与HSKMC和EA. Hy926细胞结合的流式细胞术结果。c.HSM01的结合动态曲线和统计结果。d. HSM01和HSM02在10%血清培养培养基中的血清稳定性。*p < 0.05。
接着作者对HSM01和HSM02与HAKMCs的特异性结合效果进行评估。流式细胞术显示HSM01和HSM02比对照Lib序列具有更好的结合能力。将核酸适配体HSM01和HSM02及Lib分别与FITC偶联,之后与HSKMCs和EA.hy926细胞孵育,在共聚焦显微镜下评估了细胞定位,结果显示HSM01和HSM02适配体特异性地结合在细胞膜和细胞浆上,而Lib结合弱且不可见。
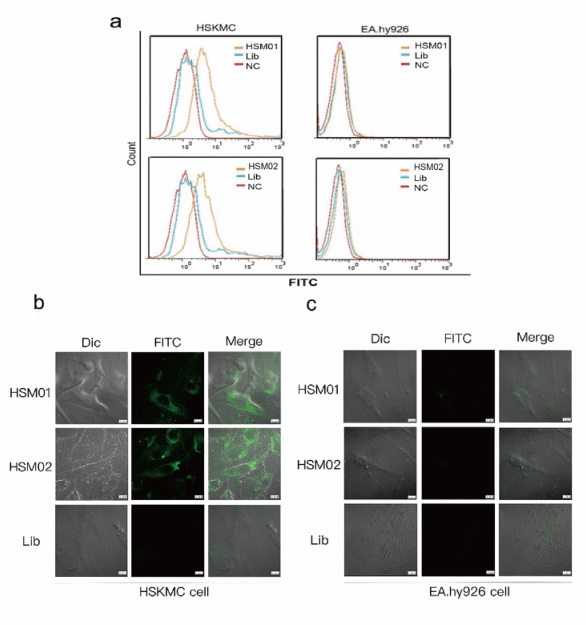
图3:与HSKMC细胞特异性结合的DNA适配体鉴定。a.流式细胞术检测HSM01和HSM02与HSKMC细胞和EA. Hy926细胞结合后,与NC组和Lib组相比曲线发生移位。b.与Lib对照组相比,免疫荧光实验显示HSM01和HSM02与HSKMC细胞有特异性荧光结合。c.与对照组相比,HSM01和HSM02与EA. Hy926细胞孵育时荧光呈阴性。比例尺为10 μm。
随后作者对小鼠体内人体骨骼肌靶向效果进行研究。向小鼠皮下注射HSKMCs,48 h后将HSM01、HSM02以及与Cy5.5荧光团耦合的Lib注入小鼠尾静脉血管,结果显示,在实验组和对照组中,适配体主要分布在高代谢器官,如肾脏和肝脏。体内药物分布实验表明该适配体稳定保留于单次注射后180分钟小鼠HSKMCs中。
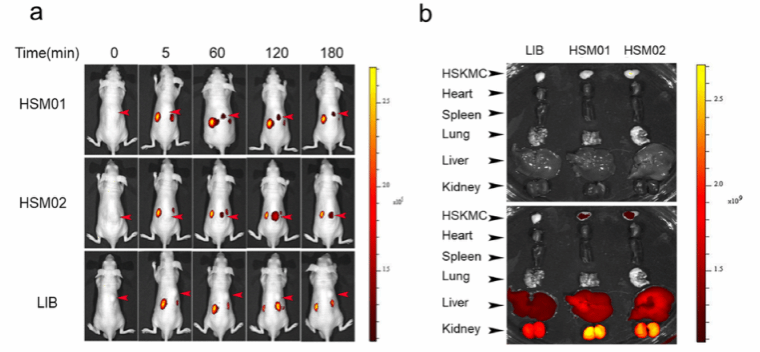
图4:适配体小鼠体内靶向实验。a.注射后5、60、120、180 min活体成像,分别为HSM01组、HSM02组、Lib组。b. 180 min心、肺、脾、肝、肾白光场和荧光场成像。
紧接着作者对核酸适配体HSM01潜在蛋白靶点进行初步分析。首先使用Nupack软件对其二维结构进行预测形成HSM01的茎环结构。其次,合成生物素偶联的HSM01和生物素偶联的Lib进行沉淀,质谱结果显示,纤维连接蛋白是HSM01样本中含量最多的蛋白质,其次是胶原蛋白-3和纤维蛋白肌动蛋白。HSM01和HSKMCs共培养结果显示HSM01对HSKMCs没有毒性。
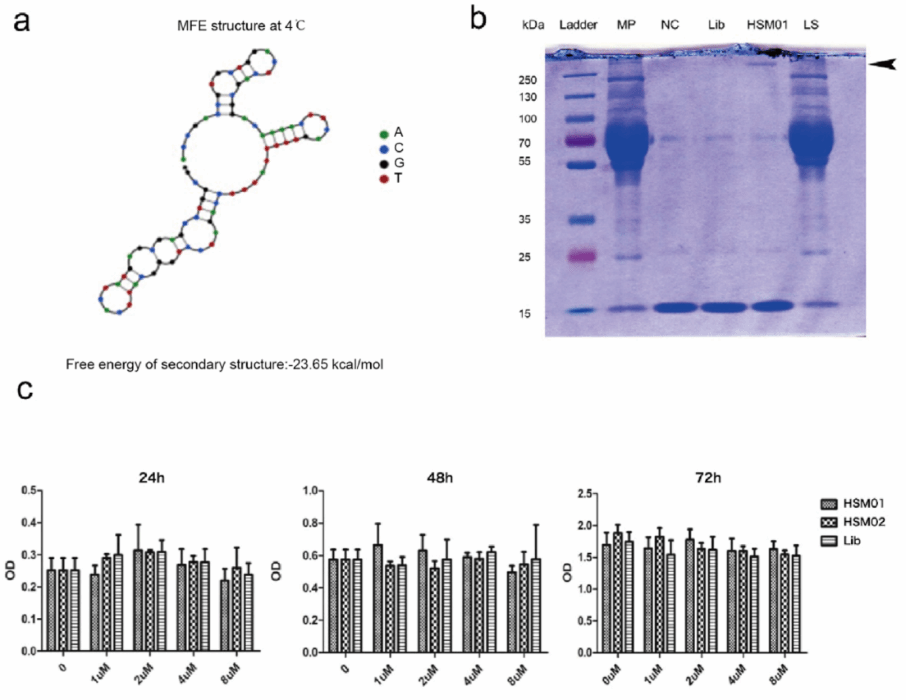
图5:适配体HSM01结构预测、蛋白沉淀及细胞处理实验。a.采用Nupack软件(http://www.nupack.org/)预测适配体二级结构(2D结构)。b.将HSKMC膜蛋白分别与生物素偶联的HSM01、Lib或空白孵育,然后加入生物素亲和磁珠洗脱靶蛋白复合物。然后采集HSM01样品、Lib样品和NC样品。HSM01样品中剩余上清液为最后上清液(LS样品)。对上述样品(MP样品、HSM01样品、Lib样品、NC样品和LS样品)进行SDS-PAGE电泳和考马斯亮蓝染色分析。在HSM01通道的250 kd以上发现了固定蛋白带。c. HSM01和HSM02对HSKMCs处理对细胞增殖的影响。
随后作者对纳米脂质体连接ssDNA适配体进行了设计与表征。为了将纳米颗粒与具有特异性靶向能力的核酸适配体耦合,在HSM01 3 '尾部添加了巯基(-SH)。此外,将聚乙二醇(PEG)插入脂质体纳米颗粒中,与适配体3 '尾部形成稳定的巯基键。通过添加胆固醇来调节纳米颗粒流动性,提高其稳定性。HSM015 '端与FITC荧光缀合,以检测合成纳米颗粒。最终,成功构建了hsm01 -脂质体复合物(Lipo-PEG-apt),结果显示Lipo-PEG-apt直径接近100 nm,均匀性良好。LE(脂质体包封率)和LC(脂质体载药率)为62.5%。Zeta电位结果显示,四组均带负电荷。
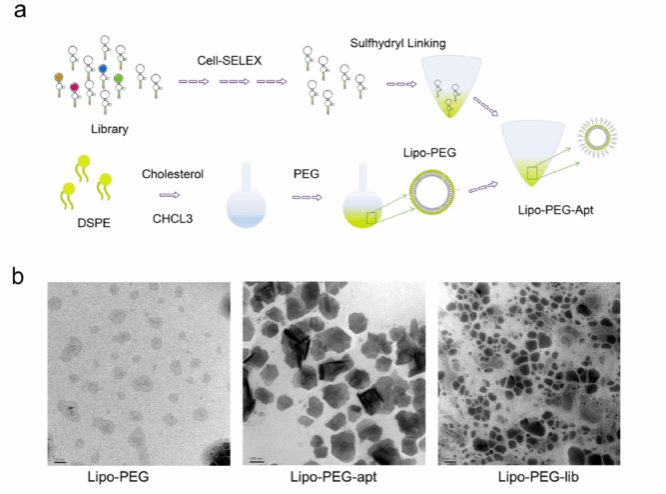
图6:Lipo-PEG-apt设计与合成。a. Lipo-PEG-apt合成示意图。采用反向蒸发法包封纳米脂质体。DSPE:二硬脂酰磷酸乙醇胺;PEG:聚乙二醇;脂肪:脂质体。b.透射电镜显示合成产物。hsm01 -脂质体复合物直径集中在100 nm左右。比例尺代表100 nm。
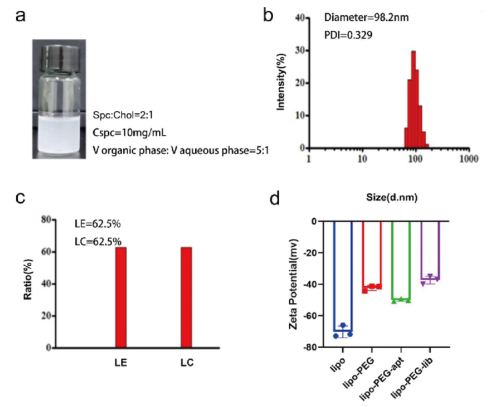
图7:Lipo-PEG-apt表征。a.合成产物大体外观和合成条件。b.直径测试。c.脂质体包封率(LE)和脂质体载药率(LC)测试。d.zeta电位测试。
接着作者对Lipo-PEG-apt在体外靶向人骨骼肌效果进行评估。本研究使用了树鼩。树鼩的肝脏和骨骼肌比小鼠和大鼠更接近灵长类动物。流式细胞仪实验显示Lipo-PEG-apt比Lipo-PEG-Lib具有明显峰结合能力,证实了Lipo-PEG-apt靶向HSKMCs能力。免疫荧光实验结果表明,Lipo-PEG-apt与HSKMCs结合,荧光强度强,进一步证实了Lipo-PEG-apt对HSKMCs细胞特异性结合能力。
为了确定Lipo-PEG-apt在体内对人骨骼肌是否具有特定靶向能力,将其分为三组,分别在0.5、1、1.5和2小时获得图像。Lipo-ICG-Lib组在骨骼肌组织中没有荧光,特别是在树鼩肢体部分,但在肝脏和肾脏中可见荧光。相反,Lipo-ICG-apt和Lipo-apt-Cy5.5组在四肢和腹肌组织中显示出强烈荧光。在Lipo-apt-Cy5.5组中,HSM0适配体被标记为Cy5.5荧光,这表明HSM01不仅可以靶向肌肉,还可以引导纳米脂质体复合体。正常情况下,脂质体不能靶向四肢和腹部肌肉组织。在HSM01指导下,Lipo-ICG-apt组表现出与Lipo-apt- Cy5.5组相似靶向能力。
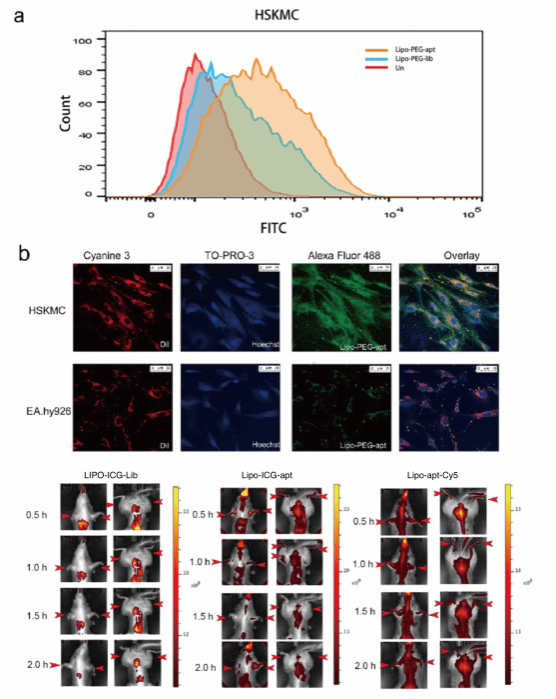
图8:Lipo-PEG-apt体内外靶向特异性评估。a.流式细胞仪实验显示HSM01 -脂质体复合物(Lipo-PEG-apt)和Lipo-PEG-Lib结合峰。b.免疫荧光显示HSM01 -脂质体复合物(Lipo-PEG-apt)绿色荧光,红色荧光(Dil,细胞膜染料),蓝色荧光(Hoechst33342)。c.树鼩分为三组,对照组脂质体与ICG荧光偶联与对照核酸底物(Lib)形成构成复合物(Lipo-PEG-Lib),一组脂质体ICG荧光偶联与实验组核酸HSM01偶联(Lipo-PEG-apt)。第三组为不含ICG荧光的脂质体,但HSM01与Cy5.5亚基偶联形成实验组(Lipo- apt-Cy5.5)。这些图像分别代表0.5 h、1 h、1.5 h和2 h。比例尺为50 μm。
最后作者为了评估Lipo-PEG-apt的生物安全性,对照组大鼠注射磷酸缓冲盐水(PBS),实验大鼠注射Lipo-PEG-apt。对肝脏和肾脏中的主要指标进行测定,结果显示,两组之间的水平没有显著差异,说明肝脏和肾脏的组织学结构和炎症在两组间没有明显差异。
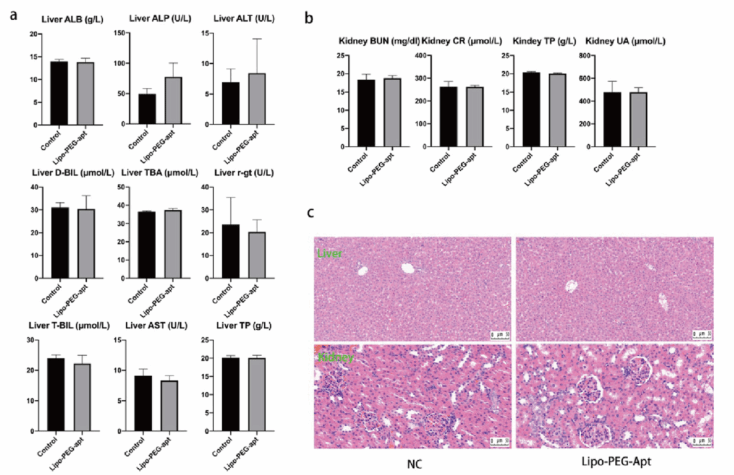
图9:大鼠肝、肾中脂质PEG-apt代谢及组织学分析。a.肝脏ALT(丙氨酸转氨酶)、AST(天冬氨酸转氨酶)、ALB(白蛋白)、ALP(碱性磷酸酶)、DBIL(直接胆红素)、TBIL(总胆红素)、r-gt(谷氨酰转肽酶)、TBA(总胆汁酸)、TP(总蛋白)水平。b.血清尿素氮(BUN)、血清肌酐(CR)、尿酸(UA)、总蛋白(TP)水平。c.肝、肾切片用苏木精和伊红染色。比例尺为50 μm。
02 论文第一/通讯作者简介
第一作者:刘晗
上海大学转化医学研究院2021级博士后。主要从事细胞外囊泡与类器官相关研究工作。以第一作者(含共一)在Adv Func Mater、Chem Eng J、Bioact Mater和Theranostics等期刊发表SCI论文12篇(中科院1区Top期刊8篇,15分以上4篇,10分以上6篇,5分以上11篇)。以第一完成人荣获“全国首届博士后创新创业大赛优胜奖”及“上海市博士后创新创业大赛优胜奖”。主持国家自然科学基金青年基金、博士后科学基金面上资助,上海市超级博士后人才激励计划,授权国家发明专利1项,参编英文专著1部。担任Frontiers in Bioengineering and Biotechnology和Frontiers in Materials评审编辑。
第一作者:孙曙明
中南大学生命科学学院,血液学基础与应用湖南省重点实验室,生物化学与分子生物学湖南省重点学科副教授,研究生导师。获得国家多项国家自然科学基金,中央军委项目基金,多项湖南省自然科学基金,发表SCI论文二十余篇,主要从事利用核酸适配体等研究工具,在多领域,多学科进行基础及初步应用研究。
通讯作者:苏佳灿
上海大学转化医学研究院院长,海军军医大学第一附属医院骨科主任医师,教授,博士研究生导师,临床医学博士,材料学博士后,国家重点研发计划重点专项首席科学家,军委科技委重点专项首席科学家,上海市青年科创英才。担任上海青年科技人才协会副会长,上海医药卫生青年联合会副主席、上海医师志愿者联盟理事长等。
以第一申请人获得国家重点研发计划重点专项,军委科技委重点专项,国自然重点项目,国自然重大研究计划集成项目、重点项目,国自然重大国际合作等科研项目20余项近8000余万元,第一完成人获省部级二等奖以上奖励4项,第一及通讯作者发表SCI论文100余篇,总影响因子>700分,包括Advanced Materials, Nano Today, Advanced Functional Materials, Advanced Science, JACS, ACS Nano, Science Advances, Small, Bone Research, Nano Letters, Biomaterials 等。申请并授权国家专利30项,主编主译20部专著。
担任中国医师协会骨科医师分会骨质疏松学组副组长,中华医学会骨科学分会骨质疏松学组委员,中国医师协会骨科医师分会青年骨质疏松学组组长,中华医学会青年骨质疏松学组组长,中国生物医学工程学会组织工程与再生医学委员会常委委员,中国生物材料学会再生医学分会委员,中国生物材料学会青年委员会委员,中国医师协会急救复苏专委会委员,中国医师协会急救复苏专委会创伤学组主任委员,中国老年学会老年病学分会副会长,中国老年学会老年病学会骨科专委会主任委员,全军骨质疏松与康复专委会副主任委员,全军基础与转化医学专委会副主任委员,上海市中西医结合学会骨质疏松专委会主任委员,上海市医学会骨科分会创伤学组委员,上海市医师协会骨科医师分会委员等。
获第20届中国五四青年奖章提名,首届全国向上向善好青年,第十七届上海市十大杰出青年,首届上海市青年英才科创奖,上海市五四青年奖章,上海市银蛇奖,上海市育才奖,上海市高校青年教师教学比赛一等奖,全国高等医学院校教学比赛一等奖,总后勤部院校教学标兵、总后勤部爱军精武标兵等奖项,荣立解放军个人二等功1次,解放军个人三等功1次。
03 资助信息
该研究获国家重点研发计划(2018YFC2001500)、国家自然科学基金(81972254、82172098)资助。
04 原文信息
Shuming Sun, Han Liu, Yan Hu, Yanpeng Wang, Mingri Zhao, Yijun Yuan, Yafei Han, Yingying Jing, Jin Cui*, Xiaoxiang Ren**, Xiao Chen***, Jiacan Su. Selection and identification of a novel ssDNA aptamer targeting human skeletal muscle.Bioactive Materials, 20, (2023) 166-178.

