近日,上海大学转化医学研究院苏佳灿教授团队在TOP期刊《Journal of Nanobiotechnology》(中科院分区一区,影响因子10.2)发表题为“Smart osteoclasts targeted nanomedicine based on amorphous CaCO3 for effective osteoporosis reversal”的研究论文。该研究成功构建了一种骨微环境响应的智能纳米药物递送系统,为骨质疏松症的治疗提供了新策略。
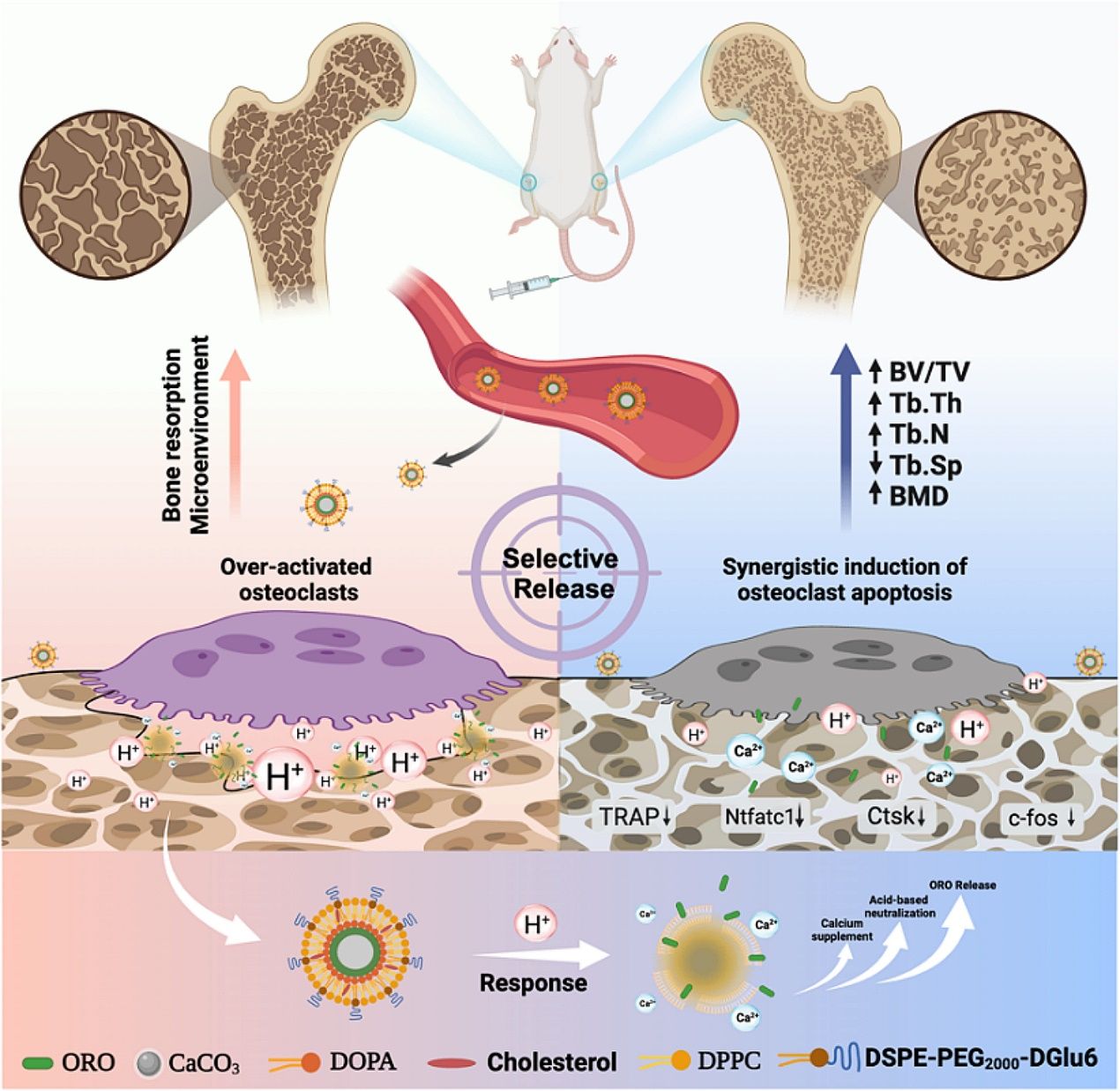
智能纳米药物递送示意图
骨质疏松症是一种以骨量减少、骨微结构破坏和骨折风险增加为特征的骨骼疾病。其发病机制与破骨细胞介导的骨吸收和成骨细胞介导的骨形成之间的失衡密切相关。破骨细胞在骨吸收过程中分泌大量酸性物质,导致局部微环境酸化,进一步加剧骨质流失。传统药物疗法存在长期使用不良反应多等问题。研究团队创新性地将天然黄酮类单体成分千层纸素(ORO)与无定形碳酸钙(ACC)结合,构建了骨靶向、pH响应的智能纳米药物递送系统(OAPLG)。通过表面修饰酸性多肽(DGlu6),纳米粒子能特异性地靶向骨组织,显著提高药物在病变部位的积累效率。无定形碳酸钙作为纳米核心,在破骨细胞分泌的酸性微环境中可快速响应并释放ORO,同时中和酸性环境,抑制破骨细胞的活性和成熟。ORO与ACC协同作用,不仅抑制破骨细胞形成和功能,还通过补充钙离子促进骨组织修复。体内外实验结果显示,OAPLG纳米粒子在模拟骨表面的酸性环境下能迅速释放药物,并有效抑制破骨细胞的形成和骨吸收功能。在去卵巢骨质疏松症小鼠模型中,OAPLG治疗组小鼠的骨量和骨微结构得到显著改善,骨质疏松相关指标明显降低,且未对机体造成明显不良反应。
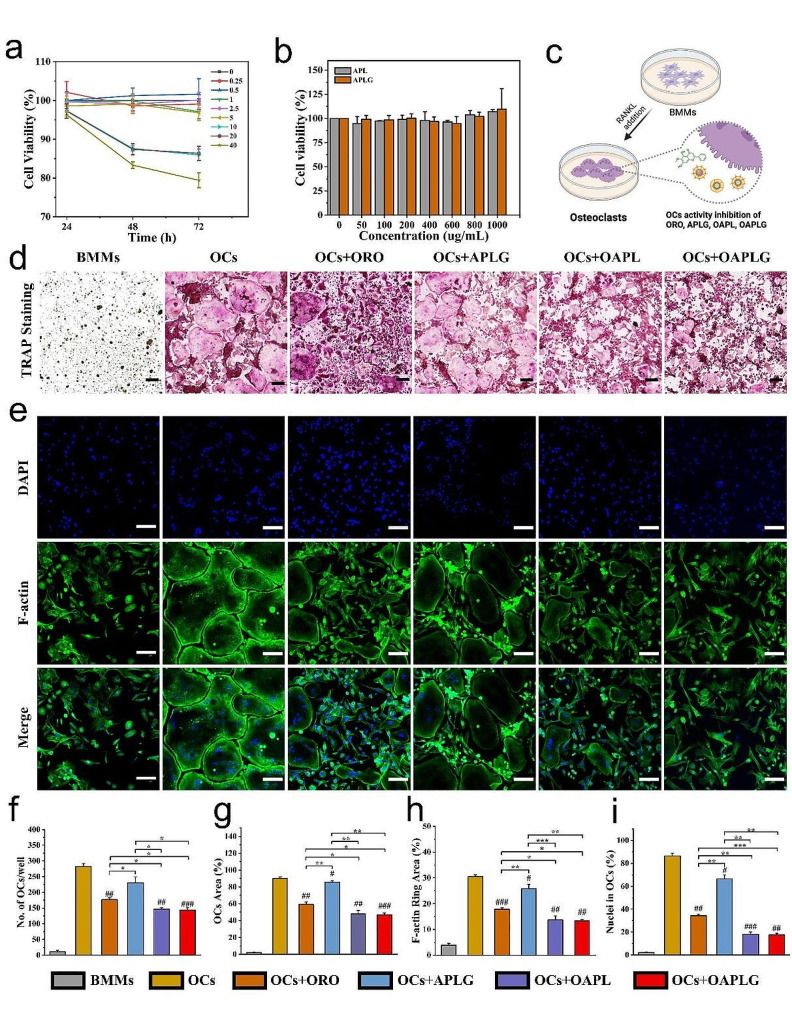
智能纳米药物抑制破骨细胞的分化
综上所述,该研究开发了一种骨微环境响应的智能纳米药物递送系统,为骨质疏松症的治疗提供了新的思路和方法。OAPLG纳米药物递送系统通过精准靶向和智能响应骨微环境,实现了对骨质疏松症的有效干预。这一成果有望为骨质疏松症患者提供更安全、高效的治疗选择,减少药物副作用等并发症的发生,提高患者生活质量。未来,研究团队将继续深入探索纳米药物递送系统在其他骨骼疾病治疗中的应用潜力,并进一步优化纳米粒子的性能,推动其临床转化。
上海大学转化医学研究院博士研究生于标、研究助理高倩闵,上海交通大学新华医院盛世豪,西安交通大学红会医院周凤金教授为论文共同第一作者。上海大学转化医学研究院苏佳灿教授、李蒙蒙副研究员、黄建平教授和王思成副教授为论文共同通讯作者。
文章链接: https://doi.org/10.1186/s12951-024-02412-9

