近期,上海大学转化医学研究院/上海交通大学医学院附属新华医院骨科苏佳灿教授团队在期刊 ADVANCED MATERIALS 上发表研究性文章:"Enzyme-Programmable DNA-PEG Hydrogel Spatiotemporally Regulates Bone Regeneration Microenvironment "。此研究工作构建酶可编程 DNA-PEG 水凝胶,实现骨再生的时序调控,主动响应骨修复微环境变化,利用 DNA 作为可控磷酸根前体,结合分子动力学模拟阐明材料诱导钙磷成核的内在机制。上海大学转化医学研究院武翔博士、汪拂晓博士后、李瑞阳博士后、于标博士为论文共同第一作者,上海大学转化医学研究院/上海交通大学医学院附属新华医院苏佳灿教授、张琴副研究员、西湖大学郑厚峰教授、上海大学转化医学研究院周东阳博士后为论文共同通讯作者。
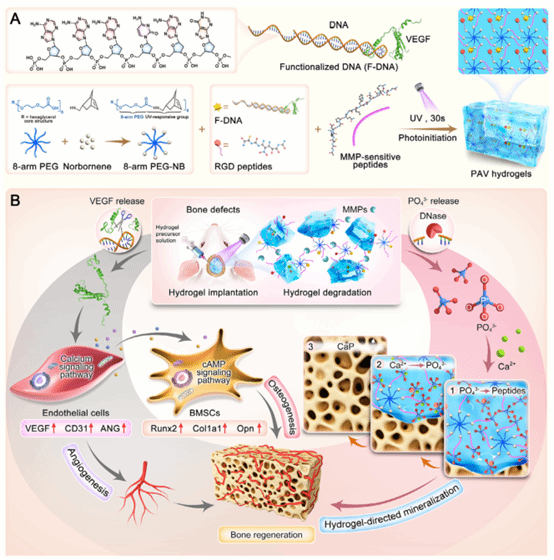
图1:用于时空控制骨再生的酶响应DNA-PEG水凝胶平台的原理和机制。
本图系统阐述了酶响应DNA-PEG水凝胶用于时空调控骨再生的整体设计理念与作用机制。该平台通过MMP介导的基质降解实现血管生成信号的按需释放,并在后期经核酸酶触发DNA降解产生磷酸根,与内源Ca²⁺协同促进矿化沉积,从而有序协调血管生成、成骨分化与矿化过程,重建有利于骨修复的动态微环境。
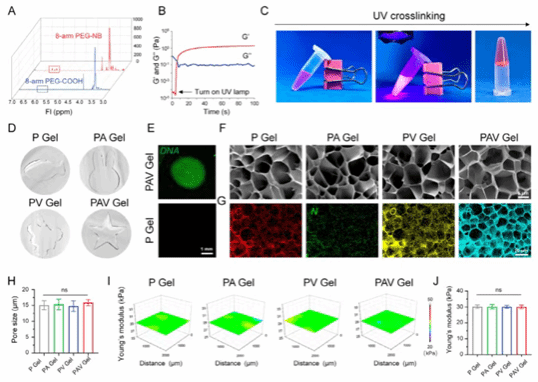
图2:PEG-DNA水凝胶的材料学表征
本图从化学结构、成胶动力学、力学性能及微观形貌等多个层面系统表征了DNA-PEG水凝胶的理化特性。结果表明,该水凝胶在紫外照射下可快速完成光交联成胶,具有良好的可注射性和可塑形能力,内部DNA分布均一,形成稳定且连通的多孔结构,同时表现出一致且可控的力学性能,为其生物应用奠定基础。
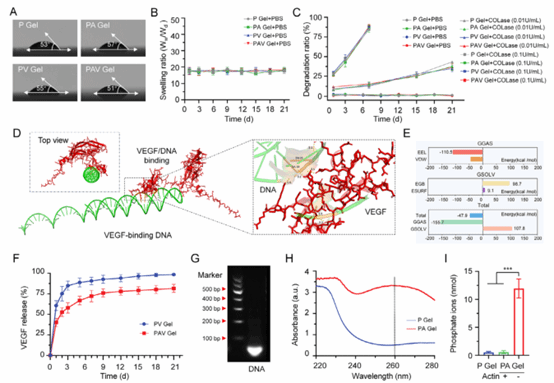
图3:PEG-DNA水凝胶的材料学表征及DNA-VEGF分子对接模拟
本图系统展示了DNA-PEG水凝胶对不同酶刺激的响应特性,表明该水凝胶在长期培养条件下能够保持稳定的理化性质和结构完整性。同时,通过DNA与VEGF之间的特异性结合,实现了促血管生成因子的可控、持续释放;在后期酶作用下,DNA逐步降解释放磷酸根,为后续矿化过程提供物质基础,从而支持血管生成与矿化的时序调控。
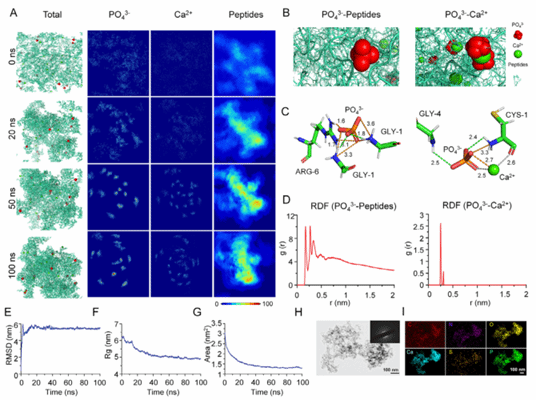
图4:DNA介导矿化的分子动力学模拟
本图通过分子动力学模拟与体外矿化实验相结合,从分子尺度系统阐明了水凝胶介导矿化的内在机制。结果显示,DNA降解释放的PO₄³⁻首先在肽段表面富集并形成稳定相互作用,随后有效招募Ca²⁺并诱导磷酸钙成核与生长,揭示了矿化过程的时序性与可控性,为理性设计促矿化生物材料提供了理论依据。
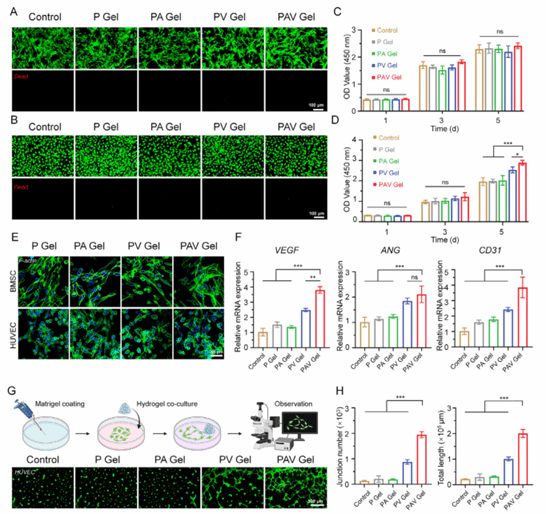
图5:水凝胶的生物相容性及成管能力评价
本图系统证明所构建水凝胶具有优异的体外生物相容性,对BMSCs和HUVECs均无明显细胞毒性,并能显著促进HUVEC的增殖活性。同时,水凝胶可上调多种血管生成相关基因的表达,增强内皮细胞成管能力,表明其能够有效激活血管生成过程,为后续成骨修复提供良好的血管化基础。
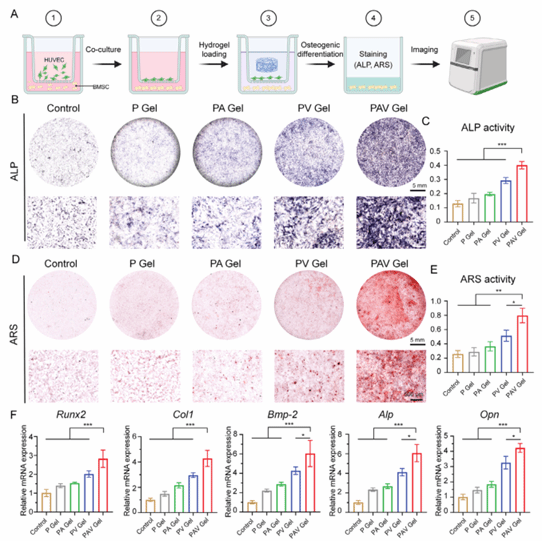
图6:水凝胶体外成骨实验
本图在内皮细胞与成骨细胞的共培养体系中系统评估了水凝胶的成骨效应。结果表明,水凝胶可显著促进BMSCs的早期成骨分化和后期矿化沉积,并明显上调多种成骨相关基因的表达水平,提示其通过内皮–成骨信号协同作用有效增强成骨微环境,充分证实了该水凝胶优异的体外成骨诱导能力。
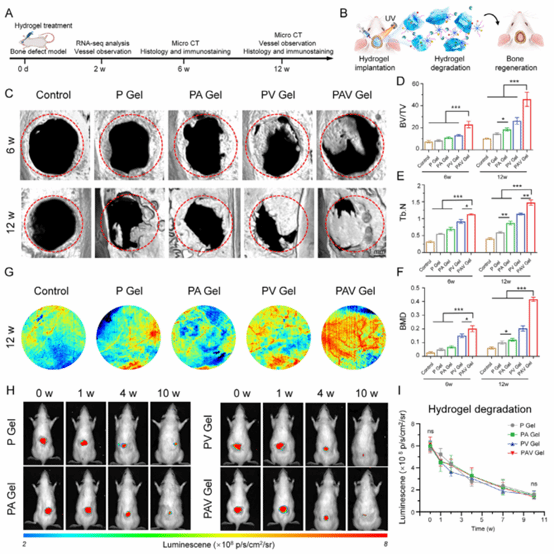
图7:水凝胶体内骨修复实验
本图在大鼠颅骨缺损模型中系统评估了水凝胶的体内骨修复效果。结果显示,水凝胶能够显著促进缺损区域早期血管生成,并进一步协同增强成骨分化与矿化沉积过程,从而有效提高新生骨体积、骨小梁数量及骨密度,加速缺损区骨结构重建,整体显著改善骨缺损修复效果,体现其良好的体内应用潜力。
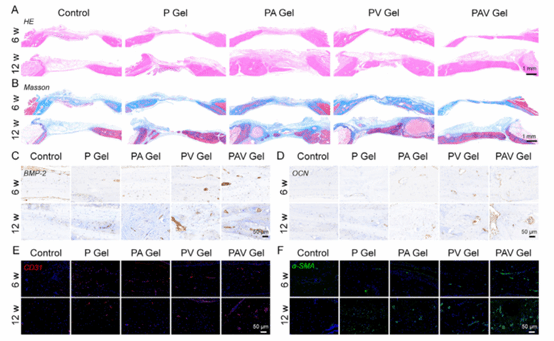
图8:骨再生修复组织学评价
本图通过组织学及免疫染色结果系统评估了水凝胶在体内的骨再生效果。结果表明,水凝胶可显著促进缺损区域胶原基质沉积,增强新生血管形成及成熟,并明显上调BMP-2、OCN等成骨相关蛋白的表达水平,显示其能够有效协同血管生成与成骨过程,从组织与分子层面证实水凝胶对血管化骨再生的显著促进作用。
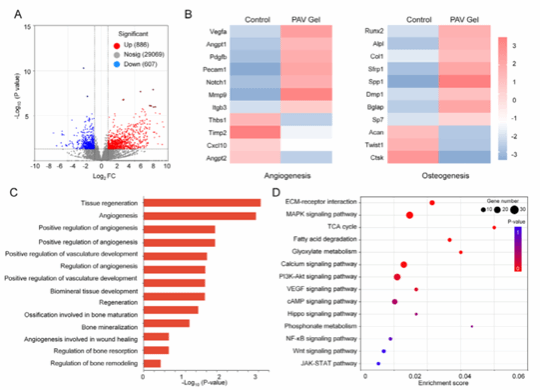
图9:骨再生修复转录组测序
本图通过RNA测序及生物信息学分析系统揭示了PAV水凝胶诱导的新生骨组织分子特征。结果表明,与对照组相比,PAV水凝胶显著上调多种血管生成、成骨及骨矿化相关基因,并富集于VEGF、MAPK等关键信号通路,从转录组层面阐明其通过协同调控血管生成与成骨过程促进骨再生的分子机制。
总结与展望
本研究构建了一种酶可编程 DNA-PEG 智能水凝胶,通过响应内源性酶信号,实现血管生成、成骨分化与矿化过程的时序协同调控,突破了传统水凝胶被动释放和单一功能的局限。该体系在分子、细胞及动物水平上系统验证了其促进骨再生的有效性,并结合分子动力学模拟阐明了水凝胶介导矿化的内在机制。未来,随着材料可编程性与计算模拟技术的进一步融合,该策略有望拓展至血管化骨类器官构建、疾病模型建立及精准再生医学研究,为复杂组织工程提供新的技术路径。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/epdf/10.1002/adma.202514461

