骨关节炎(Osteoarthritis, OA)是一种以关节软骨退变、软骨下骨异常改建、骨赘形成和关节炎症为主要特征的全关节疾病。65岁以上人群膝关节OA患病率高达50%,75岁以上患病率超过80% (1)。然而OA发病机制复杂不清,目前尚无有效干预药物,晚期以关节置换治疗为主(2)。
软骨下骨改变与OA发生进展密切相关:OA软骨下骨早期表现为骨吸收,晚期表现为骨硬化,软骨下骨病变与软骨退变存在紧密时空关联(3, 4),但其作用机理长期困扰学界:1、软骨下骨异常骨改建如何导致全关节退变?2、软骨下骨破骨细胞一过性异常激活作用是什么?3、介导OA中软骨下骨与软骨对话的关键分子有哪些?
针对上述问题,来自上海大学转化医学研究院(Institution of Translational Medicine, SHU)的苏佳灿、井莹莹教授团队/长海医院创伤骨科陈晓教授团队2023年4月5日在Science Advances杂志发表了题为Maintaining hypoxia environment of subchondral bone alleviates osteoarthritis progression的文章,该研究首次实现小鼠活体关节氧分压实时动态测量,证实OA早期软骨下骨过度激活的破骨细胞促进H型血管生成,引起关节氧微环境改变,是OA发生进展的关键环节,维持软骨下骨低氧微环境可有效延缓OA进展。

研究团队构建了前交叉韧带切除(ACLT)诱导的创伤后骨关节炎(PTOA)模型和编码L-Plastin(LPL)蛋白的Lcp1基因敲除小鼠,LPL蛋白介导破骨细胞融合及分化(5),Lcp1敲除后ACLT小鼠软骨下骨破骨活性减弱、血管生成减少、氧分压降低,小鼠软骨退变及疼痛缓解;PTOA过程中软骨细胞HIF-1α不断降解,应用腺相关病毒(AAV)敲减HIF-1α能够逆转Lcp1敲除引起的软骨保护作用;应用HIF-1α稳定剂DMOG能够延缓PTOA进展;应用LPL蛋白靶向抑制剂Oxy A能够抑制PTOA软骨下骨破骨生成、减少血管生成维持低氧微环境,缓解软骨降解及PTOA进展(图1)。
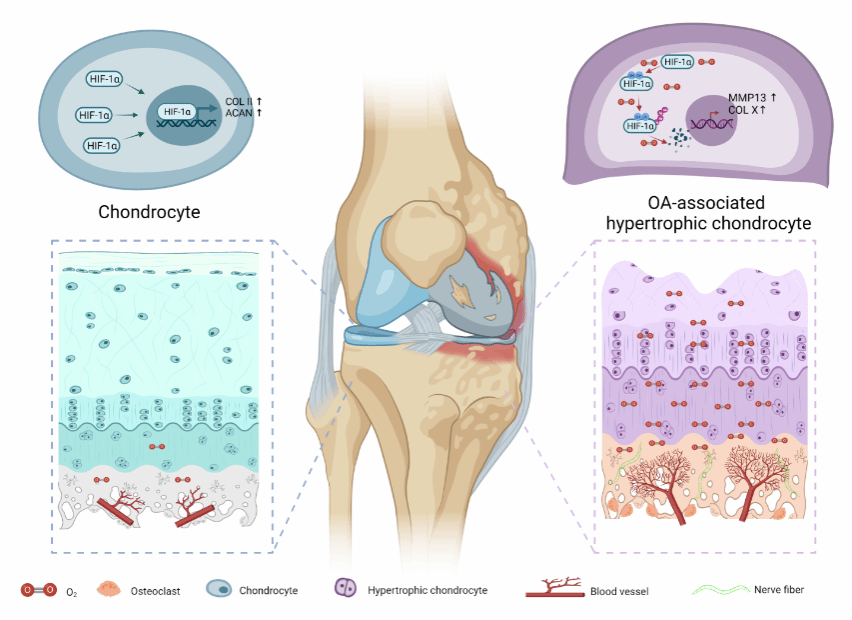
图1. 图文摘要
在PTOA小鼠,造模2周后Micro-CT结果提示骨吸收活动增强,TRAP&LPL免疫荧光提示破骨细胞达到峰值,LPL变化规律与破骨细胞一致。在Lcp1敲除小鼠,TRAP染色结果提示ACLT小鼠软骨下骨破骨形成减少,番红固绿染色结果提示软骨退变明显缓解(图2)。


图2. Lcp1敲除延缓OA进展
血管造影结果提示在Lcp1敲除小鼠,ACLT造模后软骨下骨血管体积明显减少,18F-FMISO显像结果提示OA过程中关节氧分压升高,Lcp1敲除有利于维持关节低氧微环境。通过对OA患者膝关节软骨细胞进行单细胞测序分析,课题组发现一群与OA进展密切相关的肥大软骨细胞,命名为OA相关肥大软骨细胞(OA-HTC),该群细胞OA信号通路明显上调,HIF1信号通路明显受到抑制。在ACLT小鼠进一步证实,OA进展过程中软骨细胞HIF-1α不断降解,而Lcp1敲除能够抑制HIF-1α降解。通过构建Hif1a敲减AAV,番红固绿染色结果提示Hif1a敲低能够逆转Lcp1敲除对关节软骨的保护作用。
基于前述Hif1a在保护关节软骨的重要作用,团队使用HIF-1α蛋白稳定剂DMOG干预PTOA小鼠,发现DMOG能够延缓软骨降解,维持软骨基质2型胶原表达。前述证实抑制破骨细胞LPL表达延缓PTOA进展,该团队使用LPL蛋白靶向抑制剂Oxy A治疗ACLT小鼠,结果表明Oxy A能够延缓关节软骨钙化、抑制软骨基质降解。
研究团队系统验证了PTOA过程中软骨下骨破骨细胞一过性活跃、血管化增加、低氧微环境破坏、HIF-1α降解的现象,并通过维持关节低氧环境,延缓OA进展。未来,该团队拟深入探究OA发病机制,并致力于OA治疗策略的改进和开发,从而在骨研究领域提供更多临床转化机会,构建基础研究向临床应用的桥梁。
本研究的第一作者为上海大学转化医学研究院张浩博士后、王立鹏硕士、崔进博士后和王思成博士,通讯作者为上海大学转化医学研究院苏佳灿教授、井莹莹教授和上海长海医院陈晓教授。
原文链接:http://doi.org/10.1126/sciadv.abo7868
参考文献
1. J. N. Katz, K. R. Arant, R. F. Loeser, Diagnosis and Treatment of Hip and Knee Osteoarthritis: A Review. Jama 325, 568-578 (2021).2. D. J. Hunter, S. Bierma-Zeinstra, Osteoarthritis. Lancet (London, England) 393, 1745-1759 (2019).3. W. Hu, Y. Chen, C. Dou, S. Dong, Microenvironment in subchondral bone: predominant regulator for the treatment of osteoarthritis. Annals of the rheumatic diseases 80, 413-422 (2021).4. Y. Hu, X. Chen, S. Wang, Y. Jing, J. Su, Subchondral bone microenvironment in osteoarthritis and pain. Bone research 9, 20 (2021).5. X. Li et al., Targeting actin-bundling protein L-plastin as an anabolic therapy for bone loss. Science advances 6, eabb7135 (2020).

